Asitler ve bazlar suyla çözeltilerinde iyon veren maddelerin bütünüdür. Günlük hayatta kullandığımız sabun, deterjan, deodorant, temizlik maddeleri, elma, sirke, limon, üzüm ve zeytinyağı gibi daha birçok şey asidik ve bazik yapıda maddelerdir. Bunların yanında endüstri sanayiinde, bazı kimyasal reaksiyonlarda, tarımda kullanılan gübre ve ilaçlar da asit – baz yapılı maddeler arasındadır.
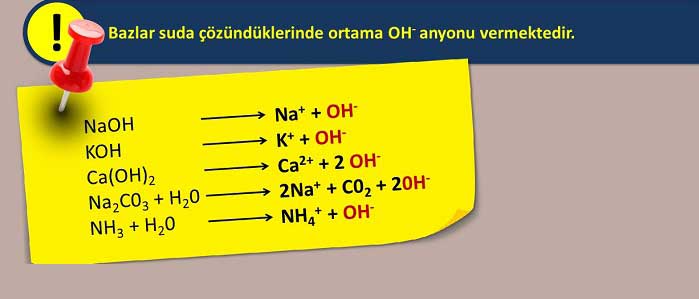
Gündelik hayatta kullanılan ürünlerin, asidik mi bazik mi olduğu bilinirse, olası zararları da önlenmiş olacaktır. Asit ve bazlarla ilgili bugüne kadar farklı tarihlerde, farklı kişiler tarafından, farklı tanımlar yapılmıştır. Asit ve baz konusunda yapılan ilk tanım Arhenius’dan gelmiştir. Ona göre asit suda iyonlaştığında hidrojen iyonu verirken, bazlar hidroksit iyonu vermektedir.
[renkbox baslik="Katran Nedir? Nerelerde Kullanılır? Özellikleri, Çeşitleri ve Faydaları Nelerdir?" link="https://bilgihanem.com/katran-nedir/" resim="https://bilgihanem.com/wp-content/uploads/2018/12/katran-nedir-nerelerde-kullanilir-ozellikleri-cesitleri-kullanim-alanlari-ve-faydalari.png" renk="siyah" yenisekme="evet"][/renkbox]
Bronsted ve Lowry tarafından yapılan tanıma göre ise proton verebilen maddelere asit, proton alabilen maddelere baz adı verilmektedir. Bu tanıma göre asit veya baz bir iyon olabileceği gibi, bir molekül de olabilmektedir.
Asit ve Baz Nedir?

H+ iyonu veren maddelere asit denirken (Asit: Su ile çözeltide H+ iyonu veren maddelerdir); H+ iyonunu alan maddelere ise baz adı verilir (Baz: Sulu çözeltide OH- iyonu veren maddelerdir). Bir asit ile onun hidrojensiz hali olan bazına, eşlenik (konjuge) asit - baz çifti adı verilir. Asit özelliği olan maddelere asidik maddeler, baz formunda olan maddelere ise bazik madde adı verilmektedir.
Asitlerin ve bazların ayrı ayrı kendilerine özgü bazı özellikleri bulunur. Bir maddenin asit mi baz mı olduğunu anlamak aslında kolay bir işlemdir. Tat alma yöntemiyle kolaylıkla tespit edilebilir. Maddenin tadında ekşilik varsa asittir, madde acı bir tat veriyorsa; bazdır. Maddelerin sulu çözeltileri incelenirse iyonların durumu görülebilir. Çözeltide H+ iyonu görülüyorsa madde asittir. OH- iyonu ise madde bir bazdır. Bir diğer yöntem de turnusol kağıdı kullanımıdır. Çözeltiye batırılan turnusol kağıdı kırmızı renk veriyorsa madde asittir. Kağıt maviye dönüyorsa madde bir bazdır.
Nötrleşme Olayı
 Nötrleşme reaksiyonu detaylı ifade edilmek gerekirse şu şekilde açıklanabilir: Asit + Baz → Tuz + H2O
Nötrleşme reaksiyonu detaylı ifade edilmek gerekirse şu şekilde açıklanabilir: Asit + Baz → Tuz + H2O
Herhangi bir asit ve herhangi bir bazın tepkimeye girmesi sonucunda tuz ortaya çıkması durumuna nötrleşme veya nötralleşme reaksiyonu adı verilmektedir. Asit maddesinden gelen H+ iyonlarının mol sayısı ve baz maddesinden gelen OH- iyonlarının mol sayısı eşit sayılardaysa ortam nötr hale gelir. Kısacası pH seviyesi 7 olarak belirlenir.
Asitlerin Genel Özellikleri

- Asitler, ekşimsi bir tada sahiptir. Örneğin; limondaki sitrik asit, yoğurt suyundaki laktik asit.
- Asit oldukları için ciltte tahrişe sebep olurlar ve sert cisimlerden mermere bile tahribat verirler.
- Su ile çözeltilerinde elektrik akımını iletme özelliğine sahiptirler.
- Bazlarla nötrleşme reaksiyonu vererek su ve tuz oluştururlar.
- İndikatörlerin rengini değiştirirler. (Ortamın asidik veya bazik olmasına göre renk değiştiren maddelere indikatör denir)
- Karbonatlı bileşiklere etki ederek CO2 gazı üretirler.
Bazların Genel Özellikleri
- Tatları acıdır.
- Ciltte hissedilebilen bir kayganlık özelliğine sahiptir. Örneğin; Sabun, sodyum bikarbonat.
- Kuvvetli bazlar yakıcı ve tahriş edicidir.
- Bazlar da su ile çözeltilerinde elektrik akımını iletirler.
- Asitlerle nötrleşme reaksiyonu vererek su ve tuz oluştururlar.
- Genel olarak metallere etki etmezler.
Günlük Hayatta Asit ve Bazların Yerleri
 Günlük hayatınızda farkında olmadan aslında birçok asit ve bazla karşılaşıyorsanız. Kimyasal açıdan düşünülmediği için dikkate alınmıyor. Örneğin tükettiğiniz yiyeceklerden limon, elma, kola, sirke, süt, kahve, üzüm ve domates en bilinen asitlerdir. Kimyasal hatta bazıları da temizlik malzemesi olan malzemelerden tuz ruhu (hidroklorik asit) ve kezzap (nitrik asit) güçlü asitlerdendir. Bazlara gelirsek; temizlikte kullandığınız deterjanlar, sabunlar, çamaşır suyu ve diş macunu en genel baz örnekleridir.
Günlük hayatınızda farkında olmadan aslında birçok asit ve bazla karşılaşıyorsanız. Kimyasal açıdan düşünülmediği için dikkate alınmıyor. Örneğin tükettiğiniz yiyeceklerden limon, elma, kola, sirke, süt, kahve, üzüm ve domates en bilinen asitlerdir. Kimyasal hatta bazıları da temizlik malzemesi olan malzemelerden tuz ruhu (hidroklorik asit) ve kezzap (nitrik asit) güçlü asitlerdendir. Bazlara gelirsek; temizlikte kullandığınız deterjanlar, sabunlar, çamaşır suyu ve diş macunu en genel baz örnekleridir.
Günlük hayatta pek kullanılmayan bazı kuvvetli asitler ve bazlar da vardır. Asitlere örnek olarak; zaçyağı, asetik asit ve yukarıdaki gibi tuz ruhu, kezzap verilebilir. Kuvvetli bazların örnekleri ise sud kostik, kireç, potas kostik ve amonyak olarak sayılabilir. Güçlü asitlerin ve bazların cildi tahriş etmek dışında özellikle mermer ve metalleri ciddi anlamda tahriş ettiği gözlemlenmiştir.
Asitler ve bazlar bir arada bulunmamalılar. Bir araya geldiklerinde tepkimelere girerler ve başka başka maddeler meydana getirirler. Tepkime sonrasında ortaya çıkan madde asit ya da baz değildir. Bu tür tepkimelere nötralleşme tepkimesi adı verilir.









yeterli değil ama iyi çok thnks
Çok iyi olmuş
GÜZEL:) :):):):):):):)
Lan sen güzel diyorsun ama ben proje ödevimi yapıyorum yeterli degil bunu bil ve her şeyede güzel:):):):):):):) deme tamamı lan sana bir şey söylerdim ama herkez okuyor neyse dedim akideş
Çok sağolun çok teşekkür ederim çok iyi hazırlamışsiniz
Bir maddenin asitmi bazmi oldugunu nasil anlariz yapman ve yapmaman gerekenler nelerdir
Cok acil pls
güzel olmuş diyenler +1 yapsın.
Hi hi hi hi hi çıbı cızık
çokkk sağolun
Çok iyi hazırlamışsınız kısa ve öz anlatım