Maddenin üç halinden biri olan gazlar, hacmi ve şekle sahip değildir. Bu nedenle koyuldukları kabın şeklini ve hacmini alırlar. Koyulduğu kabın hacmi büyüdükçe genişler, küçüldükçe sıkışır. Belli bir hacimleri bulunmadığı için bu maddeyi tanımlamak da oldukça zordur.
Gözle görülüp elle tutulamayan cisimlerdendir ve en düzensiz madde halidir. Bulunduğumuz evren içinde cisimlerin çoğu ışık veren yıldızlardır ve bunların birer gaz olduğu kabul edilmiştir. Dünya oluşumunda da ilk önceleri gaz form söz konusudur. Aynı zamanda birçok gezegen de bir gaz topudur.
[renkbox baslik="Bileşik Nedir? Bileşiklerin Sınıflandırması ve Özellikleri" link="https://bilgihanem.com/bilesik-nedir/" resim="https://bilgihanem.com/wp-content/uploads/2016/02/bilesik-nedir-bilesiklerin-siniflandirilmasi-ve-ozellikleri.jpg" renk="mavi" yenisekme="evet"][/renkbox]
Gezegenlerden elde ettiğimiz bilgilere göre gazlar, en doğal ve basit formlar olarak kabul edilmişlerdir. Gazın bir cisim olduğu çeşitli şekillerde ispat edildikten sonra yapısı hakkında araştırmalar yapılmaya başlanmıştır. Bu şekilde gaz halinde olan elementlerin birer molekül halinde olduğu tespit edilmiştir.
Gazların Genel Özellikleri
 Gazlar, tanecikleri serbest hareket eden maddelerdir. Tıpkı katı ve sıvılar gibi tanecikli yapıda olan gaz molekülleri, gelişigüzel öteleme hareketi yaparlar. Şimdi bu maddenin genel özelliklerine bakalım:
Gazlar, tanecikleri serbest hareket eden maddelerdir. Tıpkı katı ve sıvılar gibi tanecikli yapıda olan gaz molekülleri, gelişigüzel öteleme hareketi yaparlar. Şimdi bu maddenin genel özelliklerine bakalım:
- Maddenin en düzensiz halidir.
- Akışkanlığı son derece fazladır.
- Tanecikleri yüksek enerjilidir.
- Boşlukta ve diğer gazlar arasında yayılım gösterebilirler.
- Gazlar saydamdır.
- Belirli hacimleri yoktur.
- Gaz molekülleri arasında kohezyon kuvveti yoktur. Bu nedenle koyuldukları kabı doldururlar.
- Sıkılaştırılabilirler.
- Ağırlıktan bağımsız olarak basınç oluştururlar. Moleküllerin serbest hareketinden kaynaklanan bu durum, yerçekimsiz ortamda da basınçları olduğunu gösterir.
- Yoğunluğu çok azdır.
- Gazlar birbiriyle her oranda karışabilirler ve karışımları homojendir.
- Gazların genleşme katsayıları aynıdır.
- Molar hacimleri büyüktür, oda şartlarında tüm gazların molar hacimleri 24,5 litre; normal koşullarda ise 22,4 litredir,
- Bütün gazlar sıcaklık karşısında genişler.
Gazların Çeşitleri ve Özellikleri
 Gazlar kendi arasında 3’e ayrılır. Bunları tek tek inceleyecek olursak;
Gazlar kendi arasında 3’e ayrılır. Bunları tek tek inceleyecek olursak;
Eleman Gazlar (Soy Gazlar): Doğada eleman halinde bulunan bu gaz; 11 adettir. Bunlardan beş tanesi hem bileşiklerde hem de eleman halinde görülebilir. Bunlar; Oksijen (O), Azot (N), Hidrojen (H), Klor (Cl) ve Flordur (F).
Bunların dışında kalan 6 adet gaz bileşik oluşturmayan ve sürekli eleman halinde bulunan gaz çeşitleridir. Bunlar; Helyum (He), Kripton (Kr), Argon (Ar), Neon (Ne), Ksenon (Xe) ve radondur (Rn). Bu gaz çeşitleri soy gazlar olarak bilinir.
Her zaman atom halindedirler asla molekül olarak bulunmazlar. Dünyayı çevrelediği varsayılan gaz içerisinde az miktarda bulunurlar. Bu gaz çeşitleri, ışıklandırma yapmak için kullanılır. Hidrojen en hafif gazdır sonrasında ise helyum gelir. Helyum önceleri balonlarda kullanılıyordu. Günümüzde ise dalgıçlara dalma sırasında verilen oksijenin içine karıştırılmaktadır. Tehlikesiz bir gazdır.
Bileşik Gazlar: Çok fazla çeşidi olan bileşik gazlara; Karbon, Hidrojen ve Oksijen örnek verilebilir. Bu gazlar, belirli kimyasal olaylar sonrasında meydana gelirler. Özel işlerde saf bir bileşik elde etmek amacıyla kullanılırlar. Elde edilebilecek saf bileşiklere örnek olarak; kükürtlü hidrojen, azot protoksit ve asetilen verilebilir.
Karışım Gazlar: Endüstri alanında çok sık kullanılan karışım gazlar, bu alanda çok önemlidir. Farklı gazların birbirleriyle karışması ile enerji elde edilmesi mümkündür. Enerjide de bu şekilde kullanılır.
Bilinen en önemli gaz karışımı havadır. Hava içeriğinde; oksijen, azot ve az miktarda da soy gaz ve karbon dioksit bulunduran karışım gazlardan biridir. Canlı varlıkların yaşamını sürdürebilmesi için zorunlu bir gerekliliktir. Ayrıca birçok kimyasal ve fiziksel olay hava yardımıyla meydana gelir.
Gaz Kanunları
 Gazları tanımlamak için çeşitli kanunlardan yararlanılmıştır. Bu kanunların en bilindikleri şu şekildedir:
Gazları tanımlamak için çeşitli kanunlardan yararlanılmıştır. Bu kanunların en bilindikleri şu şekildedir:
Boyle Kanunu: Robert Boyle tarafından 1659 yılında ortaya atılmıştır. İngiliz fizikçi, gazın hacminin küçülmesi durumunda, basıncının da aynı miktarda büyüdüğünü ispat edebilmiştir. Bu kanunun ismi sonraki zamanlarda Boyle – Mariotte kanunu olarak anılmaya başlanmıştır.
Gay-Lussac Kanunu: Gazın basıncının ve hacminin ısı miktarı ile alakalı olduğunun keşfini Gay Lussac yapmıştır ve bu kanuna kendi adını vermiştir.
Dalton Kanunu: Dalton’a göre gaz karışımlarında, karışım içinde bulunan gazların her birinin ayrı ayrı kendi basınçları vardır ve bu toplam gaz basıncına eşittir demiştir.
Gaz Basıncı ve Buharlaşma Kavramları
 Gaz Basıncı; gazın basıncı manometre adı verilen cihazlarla ölçülür. Basıncın birimi atmosferin kendisidir. Gazlar çok küçük ve ince deliklerden geçebilme özelliğine sahiptir. Birçok gaz su içinde erir. Örneğin; su altında yaşayan canlılar, su içinde erimiş havayı kullanarak soluk alırlar.
Gaz Basıncı; gazın basıncı manometre adı verilen cihazlarla ölçülür. Basıncın birimi atmosferin kendisidir. Gazlar çok küçük ve ince deliklerden geçebilme özelliğine sahiptir. Birçok gaz su içinde erir. Örneğin; su altında yaşayan canlılar, su içinde erimiş havayı kullanarak soluk alırlar.
Buharlaşma; bazı sıvılar ve katılar sıcaklık verilmesi ile gaz haline dönüşür. Bu olaya buharlaşma adı verilir. Ayrıca hemen her gaz da sıvı hale gelebilir ama sıvı halde çok uzun süre duramazlar.
Gaz Basıncı Nasıl Ölçülür?
 Molekülleri serbest halde olan gazlar, sürekli hareket halindedir. Bu hareketten kaynaklı olarak bir basınç uygularlar. Günlük hayatımız içinde bulunduğumuz ortama uyum sağladığımız için bunu hissetmeyiz; ama farklı bir gezegen de bu hissedilebilir.
Molekülleri serbest halde olan gazlar, sürekli hareket halindedir. Bu hareketten kaynaklı olarak bir basınç uygularlar. Günlük hayatımız içinde bulunduğumuz ortama uyum sağladığımız için bunu hissetmeyiz; ama farklı bir gezegen de bu hissedilebilir.
Gazların basıncı en iyi bisiklet ve araba lastiklerinde gözlemlenebilir. Gaz basıncının ölçümde ise sıvıların basınç formülünden yararlanılmaktadır. Sıvılarda Psıvı= h * g * d şeklinde olan formüle göre basınç; sıvının yüksekliğine, yoğunluğuna ve yerçekimi ivmesine bağlıdır.
Gazların basıncı ölçülürken kullanılan sıvı ne kadar yoğunsa ölçüm o kadar kolay olacaktır. Bu nedenle hesaplama genellikle cıva ile yapılmaktadır. Bir gazın basıncı manometre veya barometre kullanılarak ölçülür.
Barometre ile Gaz Basıncı Ölçümü
Atmosfer basıncını ölçmeye yarayan düzeneklere barometre denir. Torricelli tarafından geliştirilen bu barometreler basitçe tanımlanacak olursa; silindirik bir tüpün içi boş kalacak şekilde ters çevrilir ve cıva dolu bir kaba daldırılır.
Barometrede temel prensip, atmosferik basıncın cıvayı tüpün içine doğru itmesidir. Tüpün içindeki cıva hareketi durduktan sonra tüpün suya temas ettiği noktadan basınç sabitlenirse 1 atm’nin 76 cm yüksekliğinde cıva basıncına eşit olduğu görülecektir.
Deniz seviyesi, sıcaklık gibi özellikle bu ölçümde önemli noktalardır. 1 atm = 76 cm cıva basıncı, 00C ve deniz seviyesinde yapılan ölçüme göre belirlenmiştir. Deniz seviyesinden yükseklere doğru çıktıkça basınç azalır ve sıcaklık arttıkça basınç artar.
Manometre ile Gaz Basıncı Ölçümü
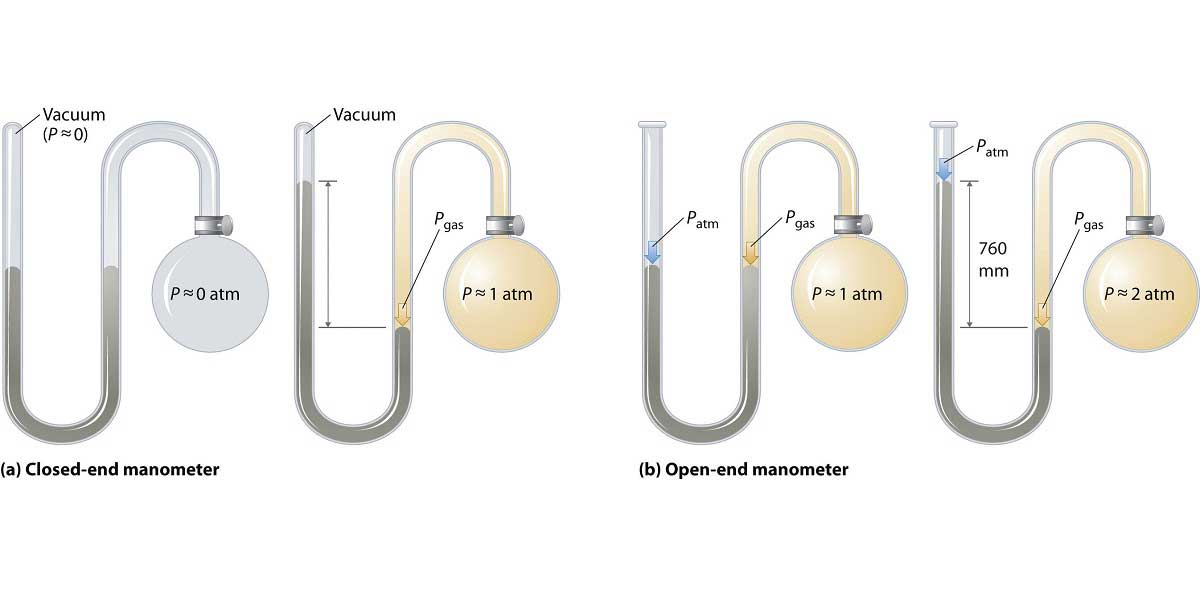
Kapalı kaplardaki gaz basıncı manometre ile ölçülür. Çalışma ilkesi ise barometre ile bir benzerlik gösterir. Kapalı ve açık olmak üzere 2 çeşit manometre bulunmaktadır.
[renkbox baslik="Kalay Nedir? Özellikleri, Kullanım Alanları ve Çıkarıldığı Yerler" link="https://bilgihanem.com/kalay-nedir/" resim="https://bilgihanem.com/wp-content/uploads/2019/01/kalay-nedir-ozellikleri-kullanim-alanlari-ve-cikarildigi-yerler.png" renk="gri" yenisekme="hayir"][/renkbox]
Manometre ile yapılan bir ölçüm denklem haline getirilirken, gazların birbirine temas ettikleri noktalar kullanılır. Yani gazın cıvayı ittiği yükseklik önemli bir noktayı oluşturmaktadır.
Açık manometreler daha çok açık hava basıncından büyük basınçların ölçümünde kullanılırlar. Kapalı manometreler ise açık hava basıncından küçük basınçları ölçmek için kullanılır.










Teşekkürler çok yararlı olmuş (;