Günümüzde bilinen 92 tanesi doğada olmak üzere 117 element vardır. Bu elementler farklı sayı ve şekillerde birleşip, etkileşerek, farklı kimyasal özelliklere sahip milyonlarca yeni bileşik meydana getirirler. Elementler doğada genelde saf halde değil bileşikler halinde bulunurlar. Elementler tek tipte bir atomdan oluşmuşken; karışımlar en az iki veya daha fazla element ya da bileşik bulundurur. Bilinen element atomlarından sadece soy gaz atomları kararlı bir yapıya sahiptir.
Kararlı oldukları için de kimyasal bağ oluşturmayıp doğada tek atomlu halde bulunurlar. Soy gazların dışındaki metal ve ametal atomları kararsız bir yapıda olduklarından, kararlı hale geçebilmek için elektron alışverişinde bulunurlar.
[renkbox baslik="Antimon Nedir? Özellikleri, Kullanım Alanları ve Çıkarıldığı Yerler" link="https://bilgihanem.com/antimon-nedir/" resim="https://bilgihanem.com/wp-content/uploads/2019/01/antimon-nedir-ozellikleri-kullanim-alanlari-ve-cikarildigi-yerler.png" renk="gri" yenisekme="evet"][/renkbox]
Elektronların ortaklaşa kullanılmasıyla kimyasal bağlar oluşur. Kimyasal bağ oluşturan farklı atomlar ise bir araya gelerek farklı kimyasal özelliklere sahip yeni maddeleri yani bileşikleri meydana getirirler.
Bileşik Nedir?
 En az iki ya da daha fazla farklı elementin atom ve iyonlarından oluşan maddelere bileşik ismi verilir. Bileşiklerin, bileşim detayları her zaman bellidir. Bir bileşik içindeki elementlerin her birinin birbirine oranı sabit birimlerdedir. Örneğin su bileşiği daima iki adet hidrojen ve bir oksijenden meydana gelir. Bileşiklerde elementin ve karışımın ayrımını yapmak gerekir. Bileşiklerin tamamı kimyevi bir reaksiyon sonucunda oluşmuştur. Reaksiyona giren olgular; iki element, bileşik ve element, bileşik ve bileşik olabilir.
En az iki ya da daha fazla farklı elementin atom ve iyonlarından oluşan maddelere bileşik ismi verilir. Bileşiklerin, bileşim detayları her zaman bellidir. Bir bileşik içindeki elementlerin her birinin birbirine oranı sabit birimlerdedir. Örneğin su bileşiği daima iki adet hidrojen ve bir oksijenden meydana gelir. Bileşiklerde elementin ve karışımın ayrımını yapmak gerekir. Bileşiklerin tamamı kimyevi bir reaksiyon sonucunda oluşmuştur. Reaksiyona giren olgular; iki element, bileşik ve element, bileşik ve bileşik olabilir.
Bileşiklerin Özellikleri Nelerdir?
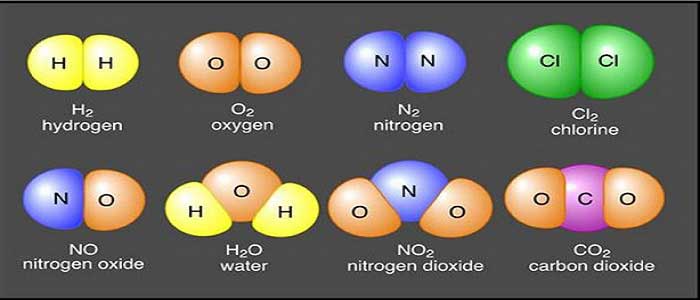
- Bileşikler kendilerini oluşturan elementlerin özelliklerini göstermezler, onlardan tamamen farklı fiziksel ve kimyasal özelliklere sahip olurlar.
- Bileşiği oluşturan elementler kendi özelliklerini kaybederler.
- Bileşiği oluşturan elementler belirli oranlarda birleşirler.
- Bileşikler oluşurken enerji alışverişi olur.
- Element ve atomlar arasında kimyasal bağ bulunur.
- Bileşikler kimyasal tepkimeler sonucu oluşur ve yine kimyasal yollarla ayrılırlar.
- Saf ve homojen maddelerdir.
- Öz kütleleri sabittir.
- Formüllerle gösterilirler.
- En küçük yapı birimleri moleküllerdir.
- En az iki farklı atom veya elementten oluşurlar.
Bileşiklerin Sınıflandırması
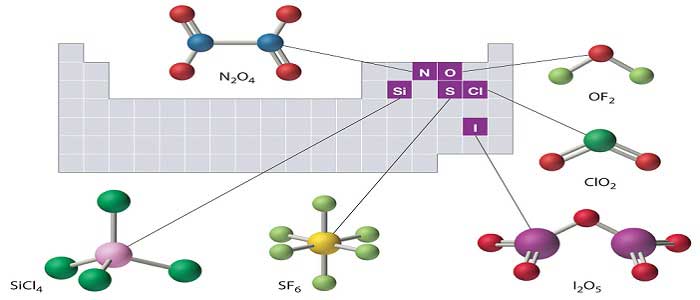 Bileşikler kendi aralarında ikiye ayrılırlar. Bunlar; anorganik ve organik bileşiklerdir.
Bileşikler kendi aralarında ikiye ayrılırlar. Bunlar; anorganik ve organik bileşiklerdir.
Anorganik Bileşikler
Çoğunlukla iyonlardan oluşan bileşiklerdir. Kimya alanında çok bilinen asitler, bazlar, tuzlar anorganik bileşiklere örnek olarak verilebilir. Bu kategorideki bileşikler genel olarak kararlıdırlar. Yani çözeltilerde ve benzeri gibi durumlarda kolaylıkla bozulma göstermezler. Kimyevi ortamda en sık görülen, bilinen ve kullanılan bileşikler anorganiklerdir. Günlük hayatta da sık sık karşılaşılan bileşik çeşitlerindendir.
Asitler: Suyla çözünmelerinde H+ iyonu elde edilebilecek bileşiklerdendir. Yani OH+ iyonuyla reaksiyona girerler. Çok kuvvetli asitler olduğu gibi günlük hayatta kullandığımız hatta yiyecek olarak tükettiğimiz asitler de bulunur. Güçlü asitler iyonlaşma özelliğine sahiptir. Güçsüz asitlerse tam anlamıyla iyonlaşmaz. Oluşan çözeltileri elektriği iletebilir. Turnusol kâğıdı ile yapılan testlerde kâğıdı kırmızı renge boyar. Asitler, bazlarla nötrleşme haline girerek su ve tuz meydana getirirler. Ekşi bir tadı vardır.
Bazlar: Su ile çözündükleri zaman OH+ iyonu verirler. Bazlar, su ile iyi bir çözünme sağlarlar. Elde edilen çözeltiler elektrik akımını iletir. Turnusol kâğıdı testlerinde verdikleri renk mavidir. Tat olarak acıdırlar. Cilde kayganlık hissi verirler. Asitlerle birleştiklerinde su ve tuz meydana getirirler. (Asitler ve Bazlar hakkında daha detaylı bilgi almak istiyorsanız, sizi buraya alalım.)
Tuzlar: Asitlerin ve bazların nötrleşmesinden ortaya çıkan üründür. Neredeyse tamamı katı formdadır. Şekil olarak birçok farklı geometrik şekle sahiptir. Yapı bakımından kristaldir. Katyonu H+ şeklinde olanlara asit, anyonu OH- şeklindekilere baz, Anyonu O- olanlara bileşik oksittir. Bu durumlar dışındaki tüm anyon – katyon bileşikleri tuz kategorisindedir. Kendi aralarında sınıflara ayrılırlar. Bunlar; asidik tuz, bazik tuz, nötr tuz, çift tuzdur.
Oksitler: O2 haricindeki oksijenin, iki ayrı türde atom barındıran tüm bileşiklerine oksit adı verilir. Bunlar da kendi aralarında sınıflandırılırlar.
- Asidik Oksitler: Oksijen bakımından zengin oksitlerdir. Asit karakterlidir. Su ile reaksiyona girmeleri durumunda asit oluştururlar.
- Bazik Oksitler: Metal malzemeler bazik olduğundan; metal oksit bileşikleri de bazik yapıdadır. Asitlerle ve asitle oluşmuş bileşiklerle reaksiyona girerler. Su ile reaksiyona girerlerse bazları meydana getirirler.
- Nötr Oksitler: Ametallerin oksijen bakımından zengin olmayan bileşiklerine verilen isimdir. NO, N2O nötr oksitlere örnektir. Ne asidik ne de bazik özellikler göstermeyen oksitlerdir. Asitle, bazla, suyla reaksiyona girmeyen bileşiklerdir.
- Anfoter Oksitler: Bu oksitler, hem asidik hem de bazik özellik gösterebilirler. Asitle karşılaşınca baz, bazla karşılaşınca asit gibi tavır gösterirler. Anfoter oksitler, asitlerle ve bazlarla reaksiyona girebilirken; su ile girmezler.
- Peroksitler: Eldeki iki adet oksijen atomunun, -2 değerli olması durumunda bileşiğin ismi peroksit olarak değişir.
- Bileşik Oksitler: Aynı elementin farklı farklı oksitlerini yapısında bulunduran bileşiklerdir. Bileşik oksitlere örnek olarak; Fe3O4 verilebilir.
Organik Bileşikler
Karbon bileşik olarak da tanınırlar. Su ile çözünmelerinde iyonlaşma meydana gelmez. Bu tür bileşiklerdeki elementleri birbirlerine bağlı şekilde tutan güç, elektronlardır. Organik bileşenler kararsızdırlar.










efso olmus allah razı olsun