Kimyasal bir bağın meydana gelebilmesi için atomlar normalinden daha kararlı bir halde olmalıdırlar. Atomların kararlı olması demek daha az enerji barındırması demektir. Bağlar oluşma esnasında dışarıya enerji açığı çıkar. Atomlar bağ kurarken; elektronların dizilişlerini, soygazların dizilişlerine benzetmeye çalışmaktadır. Bir atomun yapabileceği bağ miktarı, sahip olduğu enerji ve sahip olabileceği orbital miktarına eşittir. Atomlar birleştiklerinde elektron dağılımında değişmeler olur.
Bunun sonucunda kimyasal bağlar meydana gelir. Atom hakkında daha detaylı bilgi sahibi olmak istiyorsanız sizi buraya alalım. Çeşitli elementlerin atomlarının belli bir miktarda birleşerek bağ yapmasıyla da yeni bir madde oluşur. Bu maddeye de bileşik adı verilir. Bileşikler moleküler yapıda olabilir ya da olmayabilir. (Bakınız: Bileşik Nedir?)
[renkbox baslik="Madde Nedir? Ortak ve Ayırt Edici Özellikleri Nelerdir?" link="https://bilgihanem.com/madde-nedir/" resim="https://bilgihanem.com/wp-content/uploads/2016/01/madde-nedir-ortak-ve-ayirt-edici-ozellikleri-nelerdir.jpg" renk="mavi" yenisekme="evet"][/renkbox]
Mesela su moleküllerden meydana gelir. Suyu meydana getiren hidrojen ve oksijenin aralarında kovalent bağ bulunur. Bileşikler moleküler yapıda bulunmuyorsa; bileşiği meydana getiren atomların aralarında iyonik bağ bulunur. Böyle bileşiklere de iyonik yapılı bileşik adı verilir. Bileşikler içindeki elementlere göre formüle edilir.
Kimyasal Bağ Nedir?
 Kimyasal bağ, atomları bir arada tutan ve birbirlerine bağlanmalarını sağlayan bir kuvvettir. İki veya daha fazla çekirdek atomunun bir araya gelmesiyle oluşan kimyasal bağlar; iyonik bağlar, kovalent bağlar ve metalik bağlar olmak üzere üç gruba ayrılmaktadır.
Kimyasal bağ, atomları bir arada tutan ve birbirlerine bağlanmalarını sağlayan bir kuvvettir. İki veya daha fazla çekirdek atomunun bir araya gelmesiyle oluşan kimyasal bağlar; iyonik bağlar, kovalent bağlar ve metalik bağlar olmak üzere üç gruba ayrılmaktadır.
Kimyasal Bağların Çeşitleri Nelerdir?
 İyonik Bağlar
İyonik Bağlar
Elektronların atomlar arasında alışverişinden sonra oluşan bağlara iyonik bağlar denir. Bu tepkimeye katılan elementlerin birinin atomu, elektron sayısını kaybederek (+) yüklü iyonlara dönüşür. Kalan diğer elementin atomları da oradan gelen elektronları kazanarak (– ) yüklü iyon meydana getirirler. Böyle bir işlemde iyonlar arasında elektrostatik bir çekim gücü oluşur ve bu güç iyonları kristal içinde tutma özelliğine sahiptir. İyonik bağ ile meydana gelen bileşiklerin ortak özelliği, elektroliz edebilme özelliklerinin bulunmasıdır.
İyonik yapıda bir sıvı ya da katı çözelti elektriği iletme özelliğine sahiptir. İyonik yapıda olup; çözelti olmayan katılar ise elektriği iletmezler. İyonik bağın meydana gelişinde metal, düşük miktarda bir elektronegatifliğe sahip olması nedeniyle bir tane elektron verir ve (+) bir iyon yani katyon oluşturur. Bildiğimiz sofra tuzunda sodyum ve klor iyonları iyonik bir bağ ile bağlıdır. İyonik bağ kurulumu genel olarak metal ve ametaller arasında yaşanır. Ametal atom maddelerinin elektronegatiflik değeri yüksek miktardadır. Kolaylıkla elektron alarak anyon olabilirler. Doğal olarak da iki ya da daha çok iyon birbirlerini çekebilirler. Böyle oluşan bağlar, hidrojen bağından daha kuvvetlidir ama kovalent bağlar ile yaklaşık olarak aynı kuvvet derecesindedir.
Kovalent Bağlar
Bu bağda elektronlar, atomlar arasında aktarılmaz ve ortaklaşa kullanılır. Kısacası kutupsuz bir bağ çeşididir. Bir tane kovalent bağ, ortak kullanılan bir çift elektrondan meydana gelir. Ortaya çıkan moleküller, kovalent bağlar ile bağlanmış atomlardan oluşur.
Apolar Kovalent Bağ; Kovalent bağ, aynı cins atomlar arasında oluyorsa apolar kovalent bağ olarak adlandırılır. Soygazlar dışındaki diğer gaz halindeki elementlerin molekülleri arasındaki bağlar, apolar kovalent bağdır.
Polar Kovalent Bağ; Farklı türdeki ametal atomların oluşturduğu kutupları bulunan bağlara ise polar kovalent bağ adı verilir. Elektronlar eşit miktarda paylaşılmadığına göre kutuplaşma oluşmuş demektir. Ametallerin bir tanesi ortaklaşa kullanılır. Bundan dolayı molekülün bir tarafı artı (+ pozitif) ve diğer tarafı da eksi (- negatif) yükle yüklenir.
Metalik Bağlar
Metal olup, alaşımda bulunan bağlara verilen isimdir. Metal atomları 3 boyutlu bir yapıdadırlar ve düzenlidirler. Metalik bir atomun en dışındaki elektronlar, yapının her alanında serbest şekilde dolaşabilirler ve atomların birbirleri ile bağ kurması sağlanır.
Bir metal ve bir ametal etkileşime girdiği zaman, elektronlar, ametal atoma aktarılır. Böylece iyonik bileşik oluşur. Elektron kaybeden tarafta ise (+) yüklü iyonlar meydana gelir ve bunlara da katyon denir. Elektronu kazanan tarafta ise (– ) yüklü iyonlar oluşur. Bunlara da anyon adı verilir. Bu iki iyon bir araya geldiği zaman bir kristal meydana getirmek için birbirlerini çekme özelliğine sahiptir.
Moleküller Arası Bağlar Nelerdir?
 Maddenin üç halinden biri olan gaz halinde, aralarındaki çekme ve itme kuvveti yok denecek kadar küçüktür. Maddeler gaz halinden sıvı veya katı hale getirildiğinde aralarında bir çekim kuvveti oluşur. Oluşan bu kuvvete moleküller arası bağlar adı verilmektedir. Moleküller birbirleriyle bağ kurarken farklı tür kuvvetlerin etkisiyle bir araya gelirler. Bunlar Van der waals kuvveti, hidrojen bağları ve dipol-dipol etkileşimi gibi kuvvetlerdir. Şimdi gelin bu çekim kuvvetlerini daha yakından tanıyalım.
Maddenin üç halinden biri olan gaz halinde, aralarındaki çekme ve itme kuvveti yok denecek kadar küçüktür. Maddeler gaz halinden sıvı veya katı hale getirildiğinde aralarında bir çekim kuvveti oluşur. Oluşan bu kuvvete moleküller arası bağlar adı verilmektedir. Moleküller birbirleriyle bağ kurarken farklı tür kuvvetlerin etkisiyle bir araya gelirler. Bunlar Van der waals kuvveti, hidrojen bağları ve dipol-dipol etkileşimi gibi kuvvetlerdir. Şimdi gelin bu çekim kuvvetlerini daha yakından tanıyalım.
Van der Waals Kuvveti
En zayıf çekim kuvveti olan van der waals bağları katı ve sıvı halde bulunan, tüm polar-apolar moleküller arasında görülmektedir. H2, CO2 gibi molekül yapılı elementler, soygazlar ve apolar moleküller yalnızca van der waals bağları ile bir arada tutulurlar. Molekül kütlesi arttıkça van der waals kuvveti de artmaktadır.
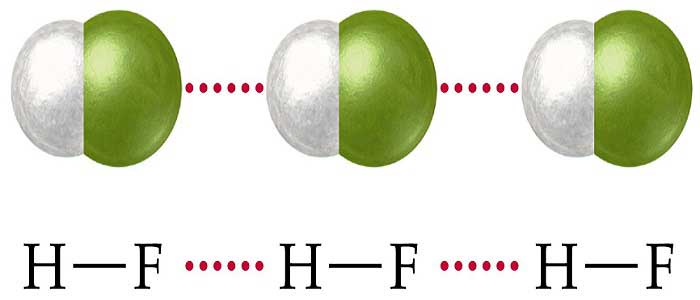
Hidrojen Bağları
Hidrojen atomunun oksijen, azot gibi elektronegatifliği büyük bir atoma bağlanması durumunda, arada oluşan bağa hidrojen bağı denir. Örneğin; H2O, CH3OH hidrojen bağı ile bağlanmış moleküllerdir.
Dipol-Dipol Etkileşimi
Dipo-dipol etkileşimi, polar moleküller arasında görülen bağdır. Molekülün artı ucu ile eksi ucu arasında oluşan elektrostatik çekim gücü dipol-dipol etkileşimi olarak adlandırılır.









işime çook yaradı çünkü snavda 100 aldım
benim de çok yaradıı hoca 100 verdi 🙂
Teşekkürler işime cok yatadı
İşime yaradı tşkler.
aynen benimde
eyw işime yaradı
O zaman iyi
Aynen o zaman iyi